Av Birger Andresen
Rydbergs formel beregner bølgelengden til lys som sendes ut når et elektron i et hydrogenatom faller fra et høyere til et lavere energinivå. Tilsvarende bølgelengder absorberes av atomet når elektronet flytter seg fra et lavere til et høyere energinivå. Bølgelengden (l) er gitt ved1/
l = R*[(1/m2)-(1/n2)]hvor n er et heltall større enn m, og R er Rydbergs konstant.
Følgende serier er de mest kjente :
- Lyman-serien (m=1) hvor elektronet faller til eller fra grunnivået.
- Balmer-serien (m=2) hvor elektronet faller til eller fra nest laveste energinivå.
- Paschen-serien (m=3).
- Brackett-serien (m=4).
- Pfund-serien (m=5).
Disse seriene er vist på figuren nedenfor.
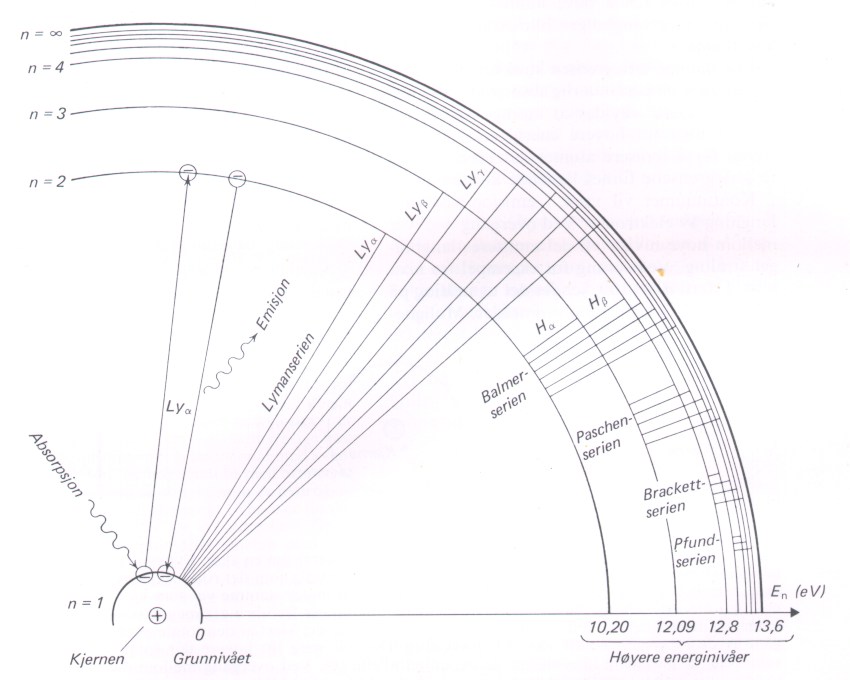
F.eks. n=4 gir Lyman g , Balmer b og Paschen a overgangene. Andre bølgelengder kan ikke et hydrogenatom i tredje energinivå over grunnivået sende ut. Men det kan i stedet absorbere alle (uendelig mange) bølgelengder i Brackett-serien (m=4 og n=5, 6, 7, 8, …).
Et hydrogenatom kan kun sende ut eller absorbere lys med de bølgelengdene som er gitt av Rydbergs formel. Dette resulterer i et emisjonsspektrum (lyse spektrallinjer) eller et absorpsjonsspektrum (mørke linjer) med akkurat disse fargene dersom kun hydrogen er tilstede. Disse overgangene er vist på figuren under.
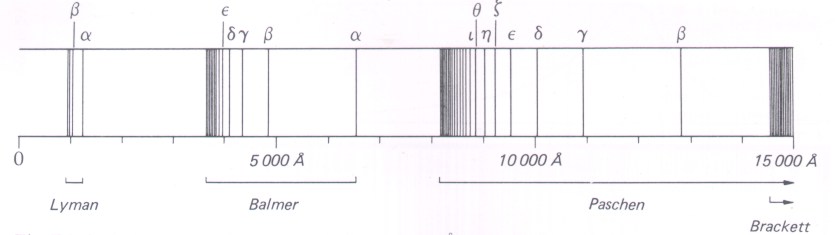
Balmer-serien ligger i synlig lys, Lyman-serien i ultrafiolett lys og de andre i infrarøde delen av det elektromagnetiske spektrum.